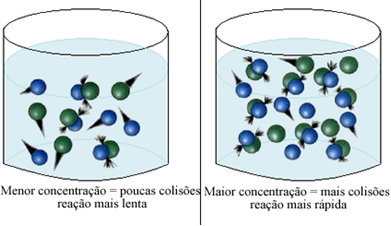
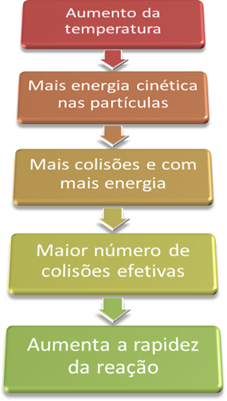
O que são símbolos químicos?
- Cada elemeto tem o seu símbolo químico. O seu símbolo químico corresponde à sua 1ª letra maiúscula, seguida qundo é necessário, de uma ou duas letras minúsculas.
- Quando se escreve o símbolo químico de um elemento, também se pode estar a representar um átomo desse elemento. EX: P- um átomo de fósforo, símbolo químico de fósforo
- Quando se quer indicar mais de um átomo ( que não está ligado quimicamente ligado a outro), deve indicar-se, antes do símbolo químico, o nº de átomos, que se quer representar. EX: 5P- 5 átomos de fósforo